1. System do mikrodysekcji laserowej - Cell Cut Plus MMI z fluorescencyjnym mikroskopem odwróconym IX 71 (Olympus)
System może być stosowany w biologii molekularnej, cytogenetyce, patologii czy medycyny sądowej.
• Mikroskop odwrócony IX 71 (Olympus) wyposażony w lampę fluorescencyjną. Obiektywy x4, x10, x20, x40
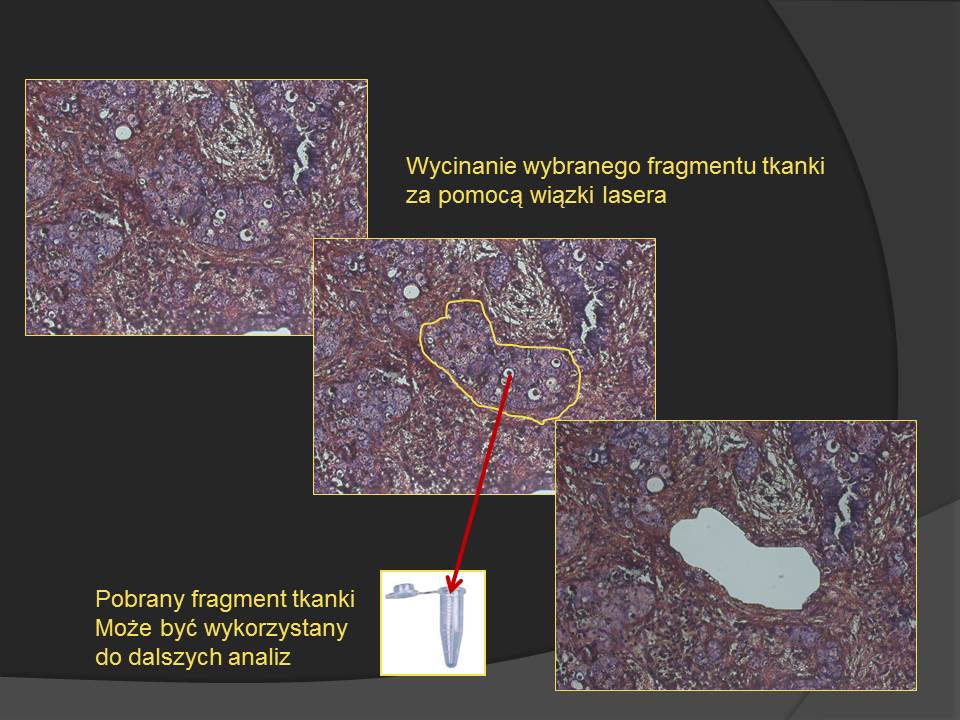
• System wyposażony w laser emitujący wiązkę światła o długości 488nm, która umożliwia precyzyjne obrysowanie i wycinanie (mikrodysekcję) wybranych fragmentów komórek z hodowli lub tkanek z preparatów histologicznych, immunohistochemicznych i immunofluorescencyjnych o standardowej grubości.
• Wymaga używania naczyń hodowlanych lub szkiełek podstawowych przeznaczonych do tego typu urządzenia, pokrytych specjalną membraną.
• Wybrane próbki (jedna lub wiele) zbierane do jałowych probówek z wykorzystaniem technologii CupLift z regulacją docisku wykorzystuje się między innymi do badań technikami biologii molekularnej.
• Kamera CCD zapewnia doskonałą jakość obrazu, która w połączeniu z intuicyjnym oprogramowaniem UVCut Plus ułatwia precyzyjne rysowanie linii cięcia obrazu.


Przydatne informacje (do pobrania):
- CellCut Plus information
- Brochure MMI CellCut
2. System do obserwacji długoczasowych in vivo - Cell Observer SD (Zeiss)
System przeznaczony jest do obserwacji zmian zachodzących w czasie, m.in. migracji, chemotaksji, a także do pomiarów dynamicznych takich parametrów, jak stężenie wapnia, pH, zmiany potencjału błonowego mitochondriów.
• Mikroskop odwrócony Axio Observer Z.1 z komorą inkubacyjną z regulacją temperatury, wilgotności, stężenia CO2 oraz O2 (możliwość uzyskania warunków hipoksyjnych) przeznaczony do obrazowania długoczasowego in vivo w szalkach Petriego (średnica 3,5-5,0 cm), szkiełkach typu Lab-Tek oraz w naczyniach wielodołkowych (6, 24, 96).
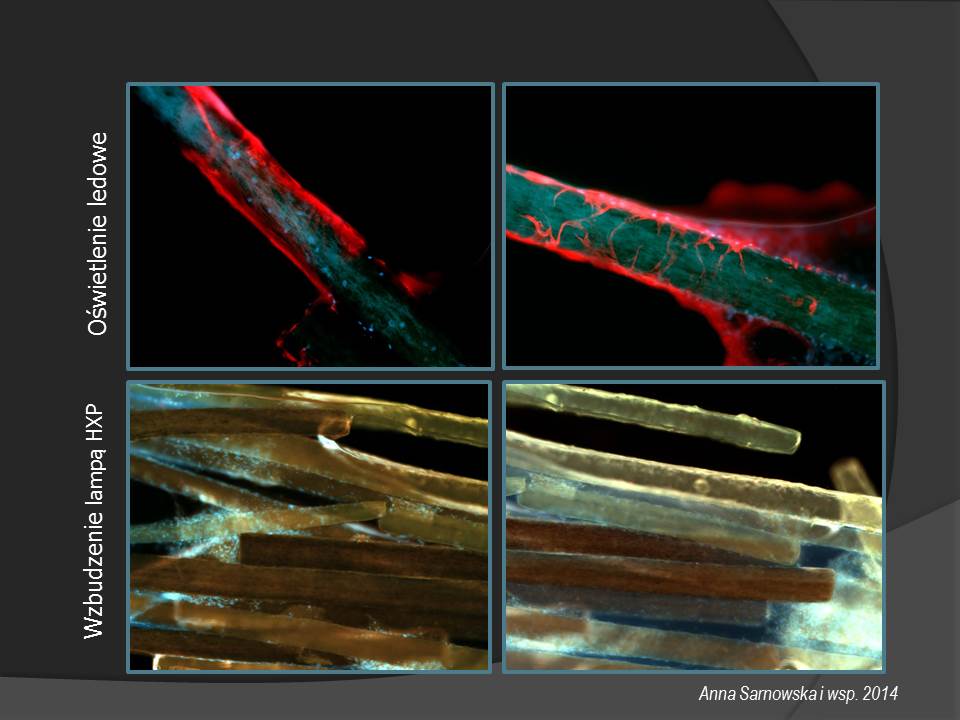
• Zmodyfikowany układ typu Spinning Disk (modyfikacja Yokogawy) z dwoma torami optycznymi i dwiema kamerami EM CCD (dual camera), oraz moduł laserowy (4 lasery diodowe - 405 nm, 488nm, 561nm, 635nm) umożliwiają bardzo szybkie obrazowanie w trybie semikonfokalnym.
• System oświetleniowy Colibri.2 - zestaw oświetlaczy typu LED: 365nm, 470nm, 540-580nm, 590nm umożliwia szybkie obrazowanie w trybie fluorescencyjnym komórek, skrawków organotypowych i tkanek oraz struktur 3D (organoidy, scafoldy) w płaszczyźnie (xy) oraz w osi (z).
• Lampa fluorescencyjna HXP 120V, trzecia kamera AxioCam MRm do rejestracji standardowej fluorescencji, system programowego korygowania ostrości Definite Focus, obiektywy do obserwacji naczyń wielodołkowych oraz preparatów na szkiełkach lub w specjalnych naczyniach hodowlanych ze szklanym dnem.
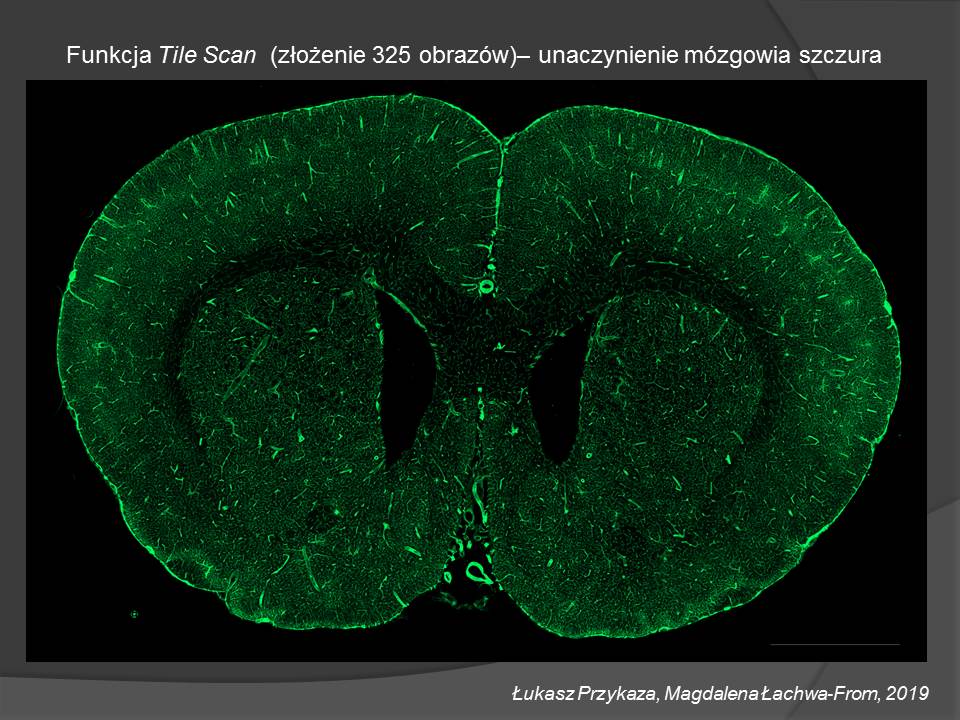
• Oprogramowanie: ZEN 2012 blue edition z modułami: Measurement (Analysis), Tiles/Positions, Experiment Designer oraz oprogramowanie typu High Content Analysis – ASSAYbuilder.

Przydatne informacje (do pobrania):
- Cell Observer SD brochure
- Axio Observer Z.1 information
- Incubation chamber
- Definite Focus information
- ZEN (blue) first steps
- AssayBuilder information
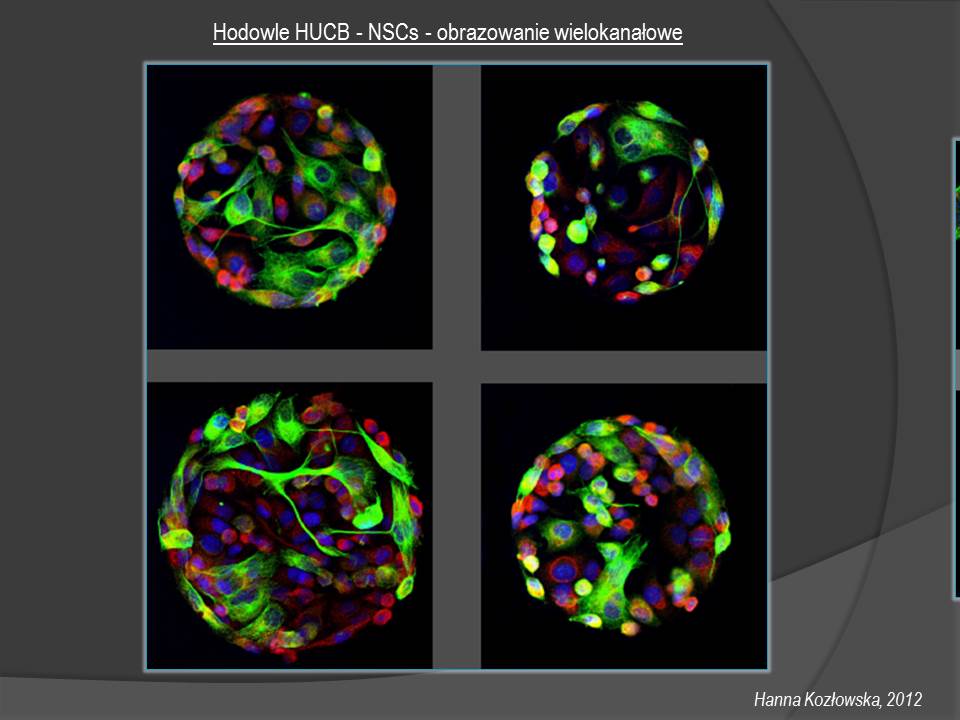
3. Mikroskop konfokalny z manualnym stolikiem - LSM 510 (Zeiss)
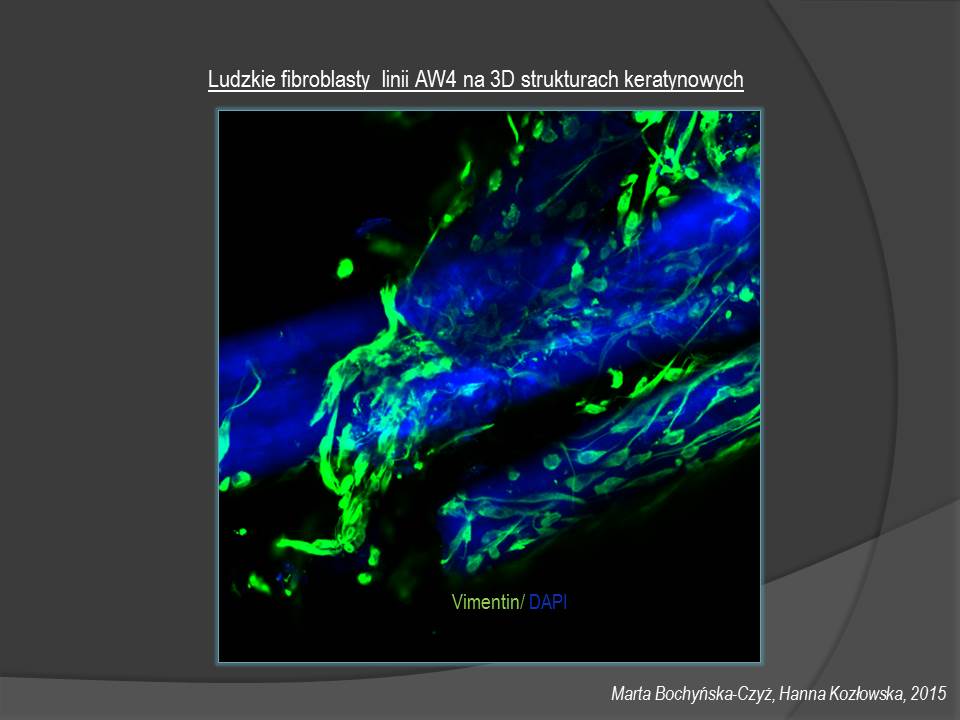
Układ z manualnym stolikiem umożliwia badania na poziomie tkanek, komórek i struktur komórkowych takich jak: jednoczesna rejestracja 4-6 sygnałów fluorescencyjnych w układach in vivo i w preparatach utrwalonych, rejestracja obrazów w osi (xy) oraz (z), obserwacje w czasie, rekonstrukcje 2,5D i 3D, projekcji ortho, a także badania fizjologiczne i pomiary dynamiczne stężenia wapnia, pH, zmiany potencjału błonowego mitochondriów.
• Mikroskop odwrócony Axiovert 200M wyposażony dodatkowo w małą komorę inkubacyjna do obserwacji w czasie, w stałych warunkach temperatury, stężenia CO2 i wilgotności.
• 4 lasery (dioda 405nm, HeNe 543nm, HeNe 633nm, Ar wieloliniowy 458/477/488/514nm).
• Kamera cyfrowa AxioCam HRm Rev.2.
• Oprogramowanie: Zen 2011 black edition. W standardzie program do pomiarów kolokalizacji.

Przydatne informacje (do pobrania):
- LSM 510 information
- Objectives brochure
- ZEN (black) information
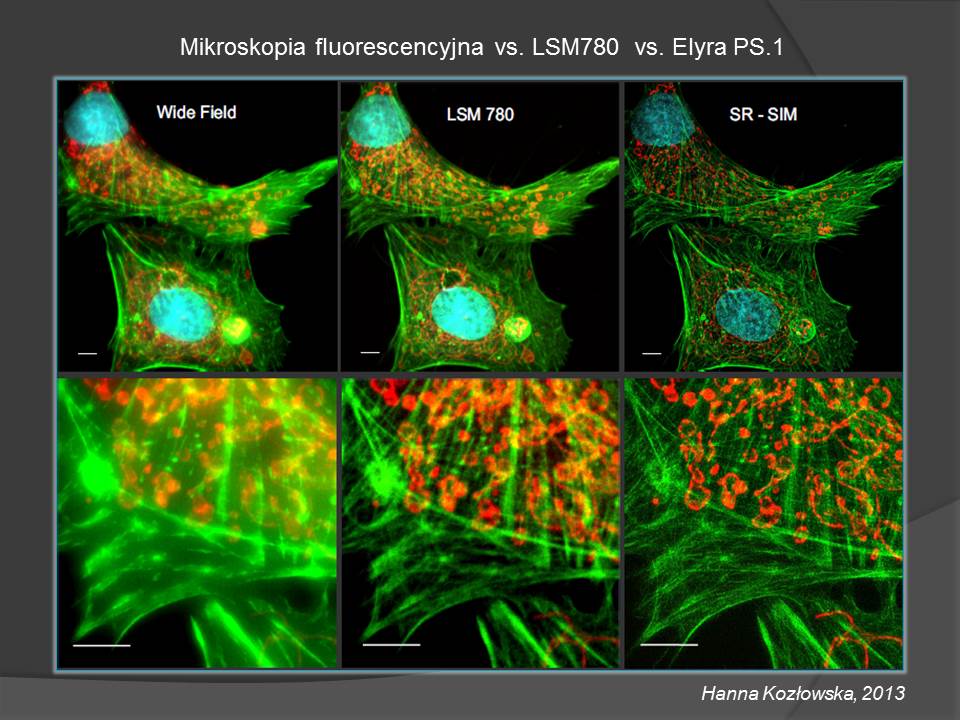
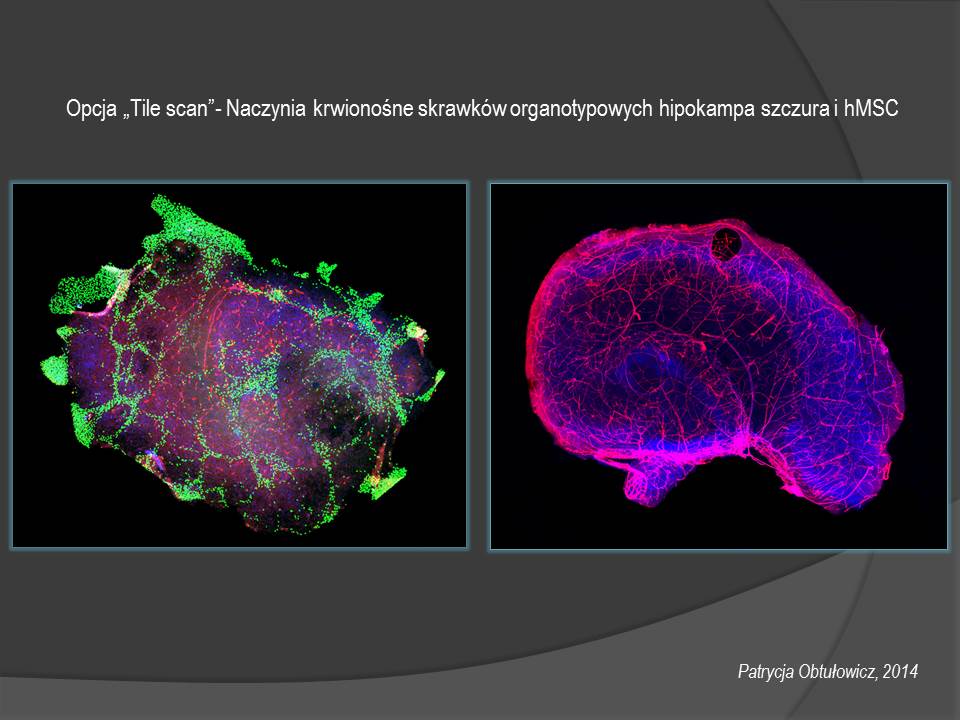
4. Mikroskop konfokalny z głowicą spektralną i głowicą super-rozdzielczą oraz z automatycznym stolikiem - System LSM 780/ ELYRA PS.1 (Zeiss)
System posiada dwa moduły: pierwszy - konfokalnej detekcji spektralnej oraz drugi super-rozdzielczy ELYRA PS.1.
Urządzenie może być wykorzystane do badania ekspresji antygenów komórkowych oraz morfologii komórek i struktury tkanek, a także do rejestracji znakowanych organelli komórkowych np. mitochondriów i macierzy zewnątrzkomórkowej.
Badania dotyczą utrwalonych hodowli komórkowych, tkanek lub skrawków organotypowych - obrazowanie wielokanałowe, kolokalizacja sygnałów, podziały komórkowe, ruch, pomiary zmian stężenia jonów wapniowych, monitorowanie zmian potencjału błonowego.
Zastosowanie czułych detektorów umożliwia minimalizowanie mocy laserów używanych w czasie rejestracji obrazów z preparatów utrwalonych. Umożliwia jednoczesną rejestrację pełnego widma sygnału i precyzyjny rozdział spektralny nakładających się sygnałów, łącznie z autofluorescencją tkanek. Dodatkowo pozwala na pomiary słabych sygnałów.
• Mikroskop odwrócony Axio Observer Z.1.
• Moduł konfokalnej detekcji spektralnej z 34 detektorami, 4 lasery (dioda 405nm, laser ciała stałego 561nm, HeNe 633nm, Ar wieloliniowy 458/488/514nm).
• Moduł super-rozdzielczości ELYRA PS.1 z 4 laserami (dioda 405nm, laser ciała stałego 561 nm, laser ciała stałego 488nm, laser ciała stałego 642nm), dwie kamery chłodzone EM CCD do rejestracji super-rozdzielczej.
• Oprogramowanie: Zen 2012 SP.5 black edition, moduły Tiles/ Positions, Experiment Designer.
ELYRA PS.1 to połączenie w jednej głowicy dwóch technik rejestracji super-rozdzielczych: SR-SIM (Superresolution Structured Illumination Microscopy) oraz PAL-M (Photo-activated Localization Microscopy) dających wszechstronność aplikacyjną prowadzonych badań. SR-SIM umożliwia rejestrację obrazów przy czterech długościach fali wzbudzającej (z możliwością nakładania kanałów) z rozdzielczością ok. 100 nm w płaszczyźnie (x,y) i 200 nm w płaszczyźnie (z) dla preparatów barwionych tak, jak do obrazowania w klasycznym mikroskopie fluorescencyjnym. PAL-M do znakowania wymaga białek podlegających fotoaktywacji lub fotokonwersji. Rozdzielczość uzyskana dzięki tej metodzie to ok. 20 nm w płaszczyźnie (x,y) i 100 nm w płaszczyźnie (z).

Przydatne informacje (do pobrania):
- LSM 780 information
- Axio Observer Z.1 information
- Objectives Brochure
- ZEN (black) information






